高中化学选修3知识点总结
二、复习要点
1、原子结构
2、元素周期表和元素周期律
3、共价键
4、分子的空间构型
5、分子的性质
6、晶体的结构和性质
(一)原子结构
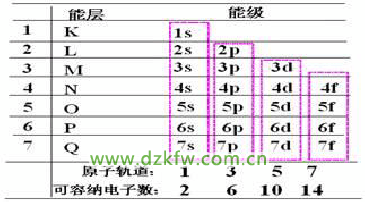
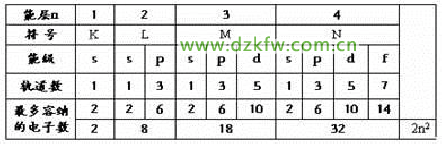
1、能层和能级
(1)能层和能级的划分
①在同一个原子中,离核越近能层能量越低。
②同一个能层的电子,能量也可能不同,还可以把它们分成能级s、p、d、f,能量由低到高依次为s、p、d、f。
③任一能层,能级数等于能层序数。
④s、p、d、f……可容纳的电子数依次是1、3、5、7……的两倍。
⑤能层不同能级相同,所容纳的最多电子数相同。
(2)能层、能级、原子轨道之间的关系
每能层所容纳的最多电子数是:2n2(n:能层的序数)。
2、构造原理
(1)构造原理是电子排入轨道的顺序,构造原理揭示了原子核外电子的能级分布。
(2)构造原理是书写基态原子电子排布式的依据,也是绘制基态原子轨道表示式的主要依据之一。
(3)不同能层的能级有交错现象,如E(3d)>E(4s)、E(4d)>E(5s)、E(5d)>E(6s)、E(6d)>E(7s)、E(4f)>E(5p)、E(4f)>E(6s)等。原子轨道的能量关系是:ns<(n-2)f <(n-1)d <np
(4)能级组序数对应着元素周期表的周期序数,能级组原子轨道所容纳电子数目对应着每个周期的元素数目。
根据构造原理,在多电子原子的电子排布中:各能层最多容纳的电子数为2n2 ;最外层不超过8个电子;次外层不超过18个电子;倒数第三层不超过32个电子。
(5)基态和激发态
①基态:最低能量状态。处于最低能量状态的原子称为基态原子。
②激发态:较高能量状态(相对基态而言)。基态原子的电子吸收能量后,电子跃迁至较高能级时的状态。处于激发态的原子称为激发态原子。
③原子光谱:不同元素的原子发生电子跃迁时会吸收(基态→激发态)和放出(激发态→较低激发态或基态)不同的能量(主要是光能),产生不同的光谱——原子光谱(吸收光谱和发射光谱)。利用光谱分析可以发现新元素或利用特征谱线鉴定元素。
3、电子云与原子轨道
(1)电子云:电子在核外空间做高速运动,没有确定的轨道。因此,人们用“电子云”模型来描述核外电子的运动。“电子云”描述了电子在原子核外出现的概率密度分布,是核外电子运动状态的形象化描述。
(2)原子轨道:不同能级上的电子出现概率约为90%的电子云空间轮廓图称为原子轨道。s电子的原子轨道呈球形对称,ns能级各有1个原子轨道;p电子的原子轨道呈纺锤形,n p能级各有3个原子轨道,相互垂直(用p x、p y、p z表示);n d能级各有5个原子轨道;n f能级各有7个原子轨道。
4、核外电子排布规律
(1)能量最低原理:在基态原子里,电子优先排布在能量最低的能级里,然后排布在能量逐渐升高的能级里。
(2)泡利原理:1个原子轨道里最多只能容纳2个电子,且自旋方向相反。
(3)洪特规则:电子排布在同一能级的各个轨道时,优先占据不同的轨道,且自旋方向相同。
(4)洪特规则的特例:电子排布在p、d、f等能级时,当其处于全空、半充满或全充满时,即p0、d0、f0、p3、d5、f7、p6、d10、f14,整个原子的能量最低,最稳定。
能量最低原理表述的是“整个原子处于能量最低状态”,而不是说电子填充到能量最低的轨道中去,泡利原理和洪特规则都使“整个原子处于能量最低状态”。
电子数
(5)(n-1)d能级上电子数等于10时,副族元素的族序数=n s能级电子数
(二)元素周期表和元素周期律
1、元素周期表的结构
元素在周期表中的位置由原子结构决定:原子核外的能层数决定元素所在的周期,原子的价电子总数决定元素所在的族。
(1)原子的电子层构型和周期的划分
周期是指能层(电子层)相同,按照最高能级组电子数依次增多的顺序排列的一行元素。即元素周期表中的一个横行为一个周期,周期表共有七个周期。同周期元素从左到右(除稀有气体外),元素的金属性逐渐减弱,非金属性逐渐增强。
(2)原子的电子构型和族的划分
族是指价电子数相同(外围电子排布相同),按照电子层数依次增加的顺序排列的一列元素。即元素周期表中的一个列为一个族(第Ⅷ族除外)。共有十八个列,十六个族。同主族周期元素从上到下,元素的金属性逐渐增强,非金属性逐渐减弱。
(3)原子的电子构型和元素的分区
按电子排布可把周期表里的元素划分成5个区,分别为s区、p区、d区、f区和ds区,除ds区外,区的名称来自按构造原理最后填入电子的能级的符号。
2、元素周期律
元素的性质随着核电荷数的递增发生周期性的递变,叫做元素周期律。元素周期律主要体现在核外电子排布、原子半径、主要化合价、金属性、非金属性、第一电离能、电负性等的周期性变化。元素性质的周期性来源于原子外电子层构型的周期性。
(1)同周期、同主族元素性质的递变规律
同周期(左右)同主族(上下)
原子结构核电荷数逐渐增大增大
能层(电子层)数相同增多
原子半径逐渐减小逐渐增大
元素性质化合价最高正价由+1+7负价
数=(8—族序数)
最高正价和负价数均相同,最高
正价数=族序数
元素的金属性和非
金属性
金属性逐渐减弱,非金属性
逐渐增强
金属性逐渐增强,非金属性逐渐
减弱
第一电离能呈增大趋势(注意反常点:
ⅡA族和ⅢA族、ⅤA族和
ⅥA族)
逐渐减小
电负性逐渐增大逐渐减小
(2)微粒半径的比较方法
①同一元素:一般情况下元素阴离子的离子半径大于相应原子的原子半径,阳离子的离子半径小于相应原子的原子半径。
②同周期元素(只能比较原子半径):随原子序数的增大,原子的原子半径依次减小。如:Na>Mg>Al>Si>P>S>Cl
③同主族元素(比较原子和离子半径):随原子序数的增大,原子的原子半径依次增大。如:Li<Na<K<Rb<Cs,F-<Cl-<Br-<I-
④同电子层结构(阳离子的电子层结构与上一周期0族元素原子具有相同的电子层结构,阴离子与同周期0族元素原子具有相同的电子层结构):随核电荷数增大,微粒半径依次减小。如:F-> Na+>Mg2+>Al3+
(3)元素金属性强弱的判断方法
金属性比较本质原子越易失电子,金属性越强。
判断依据
1. 在金属活动顺序表中越靠前,金属性越强
2. 单质与水或非氧化性酸反应越剧烈,金属性越强
3. 单质还原性越强或离子氧化性越弱,金属性越强(电解中在阴极上得电
子的先后)
4. 最高价氧化物对应水化物的碱性越强,金属性越强
5. 若x n++y x+y m+则y比x金属性强
6. 原电池反应中负极的金属性强
7. 与同种氧化剂反应,先反应的金属性强
8. 失去相同数目的电子,吸收能量少的金属性强
(4)非金属性强弱的判断方法
非金属性比本质原子越易得电子,非金属性越强
判断方法
1. 与H2化合越易,气态氢化物越稳定,非金属性越强
2. 单质氧化性越强,阴离子还原性越弱,非金属性越强(电解中在阳极
上得电子的先后)
3. 最高价氧化物的水化物酸性越强,非金属性越强
4. A n-+B B m-+A 则B比A非金属性强

 更多
更多

 返回顶部
返回顶部 刷新页面
刷新页面 下到页底
下到页底